114年7月號 •推薦報導
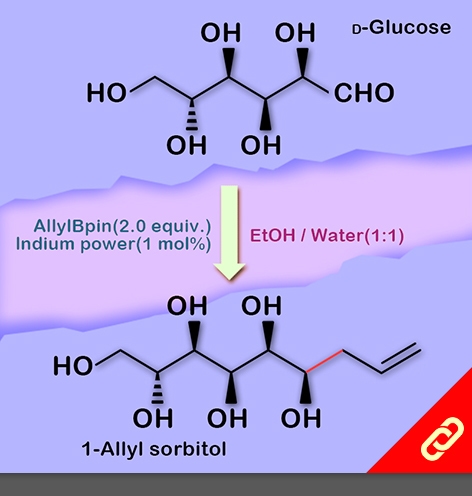
因碳水化合物價格低廉且可再生,理論上能成為化學工業上可持續發展的原料之一,但科學家目前缺乏既環保又可大規模應用的方法來有效利用它們。
114年7月號 •推薦報導
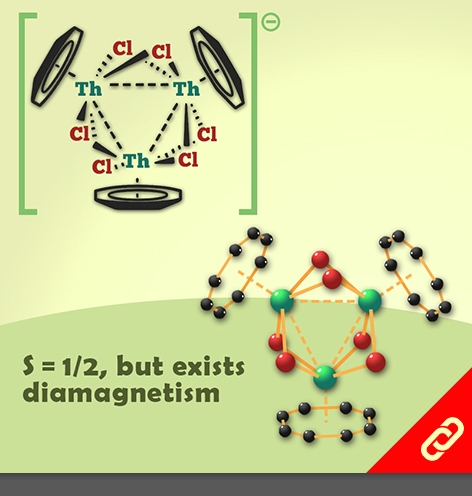
金屬奈米團簇,由於量子侷限效應(quantum confinement effects),其物理化學性質與一般的大體積金屬有明顯差異。
114年7月號 •推薦報導
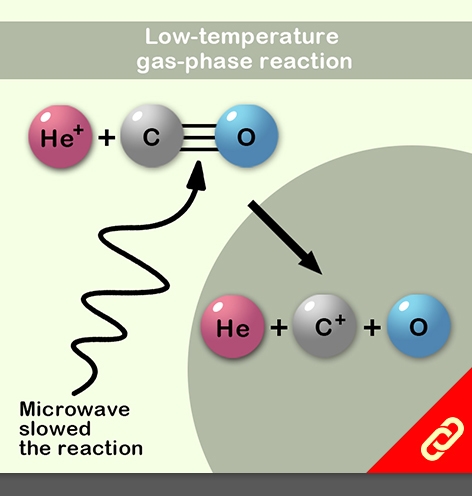
在極低溫度下,氣體分子會處於非常簡單的運動狀態,並且對周圍環境的影響特別敏感。

114年7月號 •推薦報導
環糊精(Cyclodextrins, CDs),是由葡萄糖分子首尾相連而形成的環狀結構,其中α-、β-和γ-環糊精分別包含了六、七和八個葡萄糖單元。

114年7月號 •推薦報導
環戊二烯陰離子(C5H5-)是有機金屬和配位化學中最常見的配體之一,在催化劑、材料科學和製藥領域有著廣泛應用。

114年7月號 •推薦報導
丙烯,是化學工業中的重要原料,常用於製造塑料、溶劑和許多日常用品,其每年的需求量非常巨大。

114年7月號 •推薦報導
在有機化學合成中,「選擇性」非常重要,尤其當分子中存在多個相似的反應位點時(相似官能基時)。

114年7月號 •推薦報導
去外消旋化(deracemization),是一種能將兩種鏡像異構物的混合物(即S和R的等量混合物)轉變為以單一鏡像異構物為主的方法,這使合成化學家能製備高純度的掌性化合物。

114年7月號 •推薦報導
麥角生物鹼(Ergot alkaloid),是重要的藥物化合物,廣泛用於治療各種疾病。
頁次:1 / 73
快速跳頁: